NH3 LÀ GÌ? TÍNH CHẤT, NGUỒN GỐC, ỨNG DỤNG, CÁCH ĐIỀU CHẾ & LƯ Ý KHI DÙNG
Amoniac NH3 là hóa học khí ko màu, mùi khai cùng xốc được ứng dụng làm chất gây giá trong đồ vật lạnh và sản xuất axit nitric, những loại phân đạm, điều chế hiđrazin làm cho nhiên liệu mang đến tên lửa.
Bạn đang xem: Nh3 là gì? tính chất, nguồn gốc, ứng dụng, cách điều chế & lư ý khi dùng
Vậy Amoniac NH3 và hợp hóa học của nó như muối Amoni nitrat NH4NO3 , Amoni Clorua NH4Cl xuất xắc Amoni Sunfat (NH4)2SO4 có đặc thù hoá học, đặc thù vật lý và kết cấu phân tử như vậy nào? được pha chế và ứng dụng gì trong thực tế, chúng ta hãy cùng mày mò qua bài viết này.
A. AMONIAC
I. Cấu trúc phân tử, tính chất vật lý của Amoniac NH3
1. Cấu trúc phân tử của Amoniac
- Amoniac là gì? Amoniac NH3 là hợp hóa học trong phân tử có 1 nguyên tử Nitơ sinh sống đỉnh link cộng hoá trị cùng với 3 nguyên tử Hidro ở đáy tam giác.
- cấu trúc phân tử amoniac:
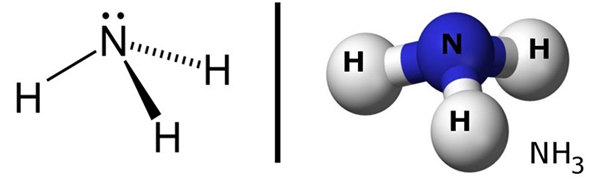
2. Tính chất vật lý của Amoniac
- Là hóa học khí không màu, hương thơm khai cùng xốc.
- Khí NH3 tan không hề ít trong nước: 1 lít nước sinh hoạt 800C có thể hòa tung 800 lít khí NH3. Amoniac là hóa học tan trong nước chế tạo ra thành hỗn hợp amoniac. Dung dịch amoniac đậm đặc bao gồm nồng độ 25%.
II. đặc điểm hoá học của Amoniac
1. Amoniac có tính bazơ yếu
- Nguyên nhân: bởi vì cặp e không tham gia link ở nguyên tử N
Ba(OH)2 > NaOH > NH3 > Mg(OH)2 > Al(OH)3
a) Amoniac phản bội ứng cùng với nước (NH3 + H2O)
NH3 + H2O ↔ NH4+ + OH-
⇒ Dung dịch NH3 làm mang lại quỳ tím chuyển màu xanh, phenolphtalein ko màu thay đổi màu hồng.
b) Amoniac làm phản ứng cùng với Axit → muối hạt Amoni
• PTPƯ: NH3 + HCl cùng NH3 + H2SO4
NH3 (khí) + HCl (khí) → NH4Cl (khói trắng)
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
c) Amoniac tác dụng với hỗn hợp muối của những kim một số loại mà hidroxit không tan → bazơ và muối
• PTPƯ: NH3 + Muối dd → Bazơ + Muối
2NH3 + MgCl2 + 2H2O → Mg(OH)2 + 2NH4Cl
3NH3 + AlCl3 + 3H2O → Al(OH)3↓ + 3NH4Cl
* Chú ý: Với muối của Cu2+, Ag+ và Zn2+ có kết tủa tiếp nối kết tủa tan bởi tạo phức hóa học tan Cu(NH3)4(OH)2; Ag(NH3)2OH; Zn(NH3)4(OH)2.
CuSO4 + 2NH3 + 2H2O → Cu(OH)2↓ + (NH4)2SO4
Cu(OH)2 + 4NH3 →
- lúc NH3 dư thì:
CuSO4 + 4NH3 →
2. Amoniac có tính khử mạnh
- Nguyên nhân: vày N trong NH3 có mức lão hóa thấp nhất -3
a) Amoniac tác dụng cùng với O2 (NH3 + O2)
4NH3 + 3O2 2N2↑ + 6H2O
4NH3 + 5O2
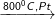
b) Amoniac tác dụng với Cl2 (NH3 + Cl2)
2NH3 + 3Cl2 N2↑ + 6HCl
8NH3 + 3Cl2 → N2↑ + 6NH4Cl
c) Amoniac tác dụng với oxit của sắt kẽm kim loại
• PTPƯ: NH3 + CuO
3CuO + 2NH3 Cu + 3H2O + N2↑

III. Điều chế cùng Ứng dụng của Amoniac
1. Điều chế Amoniac
+ vào công nghiệp: tổng hợp từ N2 và H2
N2 + 3H2 ↔ 2NH3 (4500C; Fe, p)
+ Trong chống thí nghiệm:
◊ Cho muối bột amoni chức năng với dung dịch kiềm:
NH4Cl + NaOH → NaCl + NH3 + H2O
◊ sức nóng phân muối hạt amoni
NH4Cl NH3 + HCl
NH4HCO3 NH3 + H2O + CO2
2. Cách nhận ra Amoniac
- Khí không màu nặng mùi khai.
- Khí tạo cho quỳ tím chuyển màu xanh lá cây hoặc làm cho phenolphtalein ko màu chuyển màu sắc hồng.
- sản xuất khói white với HCl đặc.
3. Ứng dụng của Amoniac
- tiếp tế axit nitric, những loại phân đạm; pha trộn hiđrazin làm nhiên liệu mang đến tên lửa.
- Amoniac lỏng được sử dụng làm chất gây giá buốt trong thiết bị lạnh.
B. MUỐI AMONI
I. Bí quyết cấu tạo, đặc điểm vật lý của Amoni
1. Bí quyết phân tử của muối hạt Amoni
- Muối amoni là muối của NH3 với axit.
- phương pháp tổng quát: (NH4)xA.
- Ví dụ: Amoni nitrat NH4NO3 , Amoni Clorua NH4Cl hay Amoni Sunfat (NH4)2SO4
2. Tính chất vật lí của muối hạt Amoni
- toàn bộ các muối bột amoni hồ hết tan cùng là phần lớn chất năng lượng điện li mạnh:
(NH4)xA → xNH4+ + Ax-
- nếu như muối amoni của axit táo tợn (A là gốc axit của một axit mạnh) thì thủy phân tạo môi trường axit.
NH4+ + H2O ↔ NH3 + H3O+
II. Tính chất hóa học tập của muối bột Amoni
1. Muối Amoni tính năng với dung dịch axit → muối mới và bazơ mới
NH4HCO3 + HCl → NH4Cl + H2O + CO2
2. Muối bột Amoni công dụng với dung dịch bazơ → muối bắt đầu + NH3 + H2O
NH4Cl + NaOH → NH3 + H2O + NaCl
3. Muối bột Amoni tác dụng với dung dịch muối → 2 muối bột mới
(NH4)2CO3 + CaCl2 → CaCO3 + 2NH4Cl
4. Muối hạt amoni còn dễ dẫn đến phân hủy vì chưng nhiệt → NH3 và axit tương ứng. Xem thêm: Top 10 Kem Dưỡng Trắng Da An Toàn, Top 15 Kem Dưỡng Trắng Da Mặt Tốt Nhất 2021
NH4Cl NH3 + HCl
NH4HCO3 NH3 + H2O + CO2
- giả dụ axit tạo thành có tính oxi hóa khỏe khoắn thì axit đó sẽ oxi hóa NH3 để tạo thành các thành phầm khác:
NH4NO2 → N2 + 2H2O
NH4NO3 → N2O + 2H2O
III. Bí quyết điều chế và nhận biết muối Amoni
1. Điều chế muối hạt Amoni
- NH3 + axit.
- cần sử dụng phản ứng điều đình ion.
2. Dấn biết muối Amoni
- muối hạt amoni sinh sản khí hương thơm khai với dung dịch kiềm
NH4+ + OH- → NH3 + H2O
C. BÀI TẬP VỀ AMONIAC VÀ MUỐI AMONI
Bài 2 trang 37 SGK hóa 11: Hoàn thành sơ đồ gửi hóa sau và viết các phương trình hóa học:
Khí A
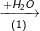
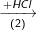
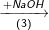
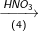
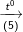
Biết rằng A là hợp chất của nitơ.
* giải thuật bài 2 trang 37 SGK hóa 11:
- các phương trình bội nghịch ứng hóa học:
(1) Khí NH3 + H2O
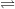
(2) NH3 + HCl → NH4Cl
(3) NH4Cl + NaOH → NH3↑ + NaCl + H2O
(4) NH3 + HNO3 → NH4NO3
(5) NH4NO3 → N2O↑ + 2H2O
Bài 3 trang 37 SGK hóa 11: Hiện nay, để chế tạo amoniac, bạn ta pha trộn nitơ cùng hiđro bằng cách chuyển hoá bao gồm xúc tác một lếu hợp có không khí, hơi nước với khí metan (thành phần bao gồm của khí thiên nhiên). Bội nghịch ứng thân khí metan và hơi nước tạo ra hiđro với cacbon đioxit. Để loại khí oxi và thu khí nitơ, fan ta đốt khí metan trong một thiết bị kín đáo chứa ko khí.Hãy viết phương trình hoá học tập của phản ứng pha trộn khí hiđro, các loại khí oxi và tổng đúng theo khí amoniac?
* giải thuật bài 3 trang 37 SGK hóa 11:
- Phương trình pha chế hiđro
CH4 + 2H2O -to, xt→ CO2 + 4H2
- Phương trình nhiều loại khí oxi:
CH4 + 2O2 -to→ CO2 + 2H2O
- Phương trình tống thích hợp amoniac:
N2 + 3H2
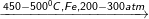
Bài 4 trang 38 SGK hóa 11: Trình bày phương thức hoá học nhằm phân biệt những dung dịch: NH3, Na2SO4, NH4Cl, (NH4)2SO4. Viết phương trình hoá học của các phản ứng vẫn dùng.
* giải mã bài 4 trang 38 SGK hóa 11:
- mang đến quỳ tím vào cụ thể từng ống: ống màu xanh là dung dịch NH3; nhì ống bao gồm màu hồng là NH4Cl và (NH4)2SO4; ống không tồn tại hiện tượng gì là Na2SO4.
- mang lại Ba(OH)2 vào nhì ống có tác dụng hồng quỳ tím. Trường hợp thấy ống nào gồm khí bay ra hương thơm khai là NH4Cl, ống vừa bao gồm khí cất cánh ra mùi hương khai vừa gồm kết tủa là (NH4)2SO4.
(NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O
2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3↑ + 2H2O
Bài 5 trang 38 SGK hóa 11: Muốn cho cân bằng của phản ứng tổng thích hợp amoniac sang phải, rất cần phải đồng thời:
A. Tăng áp suất và tăng sức nóng độ.
B. Sút áp suất và hạ nhiệt độ.
C. Tăng áp suất và giảm nhiệt độ.
D. Giảm áp suất cùng tăng sức nóng độ.
* lời giải bài 5 trang 38 SGK hóa 11:
- Đáp án: C. Tăng áp suất và hạ nhiệt độ.
- bội phản ứng pha trộn NH3:
Chiều thuận: N2 + 3H2
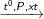
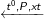
* giải thuật bài 6 trang 38 SGK hóa 11:
- Phương trình phản bội ứng nhiệt phân:
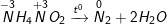
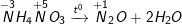
- Trong hai phản ứng bên trên số oxi hoá của nitơ trong mỗi phản ứng những thay đổi. Trong mỗi phân tử muối hạt một nguyên tử nitơ gồm số oxi hoá tăng, một nguyên tử gồm số oxi hoá giảm, đó là phản ứng oxi hoá khử nội phân tử.
- Ở cả nhị phản ứng nitơ nguyên tử trong ion NH4+ đều là hóa học khử (chất mang đến e) nitơ trường đoản cú số oxi hoá -3 tạo thêm 0 ở phản bội ứng (1) và lên +1 ở phản nghịch ứng (2).
- Nguyên tử nitơ trong ion NO2- và NO3- là chất oxi hoá (chất thừa nhận e). Ở phản ứng (1) số oxi hoá của N trường đoản cú +3 (trong NO2- ) xuống 0 cùng ở phản bội ứng (2) số oxi hoá của nitơ tự +5 (trong NO3-) xuống +1.
Bài 7 trang 38 SGK hóa 11: Cho hỗn hợp NaOH dư vào 150,0 ml dung dịch (NH4)2SO4 1,00M, đun nóng nhẹ.

 Xem phim học yêu
Xem phim học yêu Chuyện tình con rể mẹ vợ
Chuyện tình con rể mẹ vợ Liêu trai chí dị 1
Liêu trai chí dị 1 Phim châu âu bị cấm chiếu
Phim châu âu bị cấm chiếu Hình ảnh girl xinh gái đẹp mặc bikini siêu gợi cảm
Hình ảnh girl xinh gái đẹp mặc bikini siêu gợi cảm Đeo 2 nhẫn trên 1 bàn tay
Đeo 2 nhẫn trên 1 bàn tay Tạo ảnh bìa hình nền theo tên của bạn trong 2021
Tạo ảnh bìa hình nền theo tên của bạn trong 2021 Dây chuyền bạc bị chuyển màu đồng
Dây chuyền bạc bị chuyển màu đồng Harry potter 3 lòng tiếng htv3
Harry potter 3 lòng tiếng htv3 Đầu bị lõm ở giữa
Đầu bị lõm ở giữa Satria 2 thì giá bao nhiêu
Satria 2 thì giá bao nhiêu Các cặp tướng mạnh trong rise of kingdom
Các cặp tướng mạnh trong rise of kingdom Cách kiểm tra vaseline that giả
Cách kiểm tra vaseline that giả Tóc tỉa layer ngắn ngang vai
Tóc tỉa layer ngắn ngang vai Sheet, nốt nhạc piano bụi phấn có lời và hợp âm đầy đủ
Sheet, nốt nhạc piano bụi phấn có lời và hợp âm đầy đủ